Este artículo es uno de los proyectos finales del curso Narrar la Ciencia en el Siglo XXI, dictado por la Fundación Persea en colaboración con la Universidad El Bosque, Bogotá, Colombia.
Por: Maricef Vergara-Rubio
El secretismo sobre los protocolos experimentales en el país que atraviesa una de las peores crisis económicas, sociales y políticas de Latinoamérica no parece otra cosa que la crónica de una muerte anunciada. Este seguimiento y esfuerzo de investigación, presenta algunos matices actuales y antecedentes a la inscripción oficial del polémico estudio clínico desde el primer año de la pandemia.
Venezuela, país otrora considerado rico por tener las mayores reservas de petróleo del mundo, actualmente ostenta el mayor éxodo migratorio de la región agudizado por la compleja crisis humanitaria que afecta al país desde 2016, y lidia paralelamente con el aumento de muertes por COVID-19. En este contexto, y poco después de que el Ministerio del Poder Popular para la Salud anunciara la participación de dos mil venezolanos en los ensayos clínicos fase III de Sputnik V (octubre 2020), la Academia Nacional de Medicina y la Academia de Ciencias Físicas, Matemáticas y Naturales publicó un comunicado haciendo recomendaciones al Estado para garantizar que las pruebas cumplieran con los más altos niveles científicos y éticos.
Sobre perspectivas éticas, ensayos clínicos y vacunas
Tres premisas básicas deben cumplirse en toda investigación en seres humanos:
- “Primum non nocere” (primero no dañar).
- La ética aplica para todas las fases del ensayo clínico.
- Un buen diseño de investigación debe responder a preguntas importantes sobre salud pública sin perjudicar el bienestar de los participantes. Para que se cumplan, toda experimentación realizada en humanos debe hacerse de acuerdo con ciertos principios éticos fundamentales.
Según el código de ética médica de Núremberg, que se produjo al final de la Segunda Guerra Mundial, los principios para la experimentación en seres humanos son la autonomía o respeto a las personas, la búsqueda del bien (principios de beneficencia/no maleficencia) y la justicia.
«Quizás el más importante es el principio de autonomía. Es un proceso mediante el cual el voluntario entiende perfectamente a qué se está sometiendo» dijo José Esparza, destacado virólogo venezolano, exintegrante del programa global de la OMS para el VIH/SIDA.
En este caso se trataba de un candidato vacunal. Solamente un grupo de los voluntarios recibiría el producto experimental, mientras que los otros participantes, un placebo. No se debería engañar a la población haciéndoles creer que están recibiendo una vacuna efectiva.
Por su parte, la OMS ha hecho un pronunciamiento en el que exhorta:
«Dados los principios éticos de equidad y justicia que deben prevalecer en toda investigación, se debe abogar para que todo individuo pueda tener acceso a vacuna, pruebas y tratamientos para la infección COVID-19»
Fases de desarrollo de una vacuna
Los diferentes estudios de investigación tienen como prioridad la seguridad de uso de una vacuna y enseguida su eficacia. Los estudios son realizados en fases: fase preclínica y clínicas (de investigación en humanos) I, II, III, y IV.

Fases de desarrollo de un avacuna. Infografía realizada por Gabriela Chacón.
Cronología de un ensayo clínico en plena pandemia, capítulo Venezuela
Año 2020: indicios prematuros o extraoficiales
Anunciado el inicio de pruebas clínicas en Venezuela que refiere a distintas fechas de 2020 y que responden a las fuentes consultadas (entre las que destacan autoridades gubernamentales o sanitarias y voluntarios venezolanos e incluso extranjeros como el expresidente de Honduras: Manuel Zelaya) hasta el momento, el ensayo no parece haber reclutado participantes y no ofrece actualizaciones desde su primer posteo: el 24 de noviembre de 2020, según la base de datos de estudios clínicos financiados con fondos públicos y privados realizados en todo el mundo ClinicalTrials.gov.

En el siguiente tuit Manuel Zelaya comparte un video sobre su participación en la fase III de la vacuna rusa Sputnik V
.@NicolasMaduro y el Pueblo de Venezuela, me permitieron iniciar la fase 3 de vacuna Rusa SPUTNIK V Aplicada en Centro científico. ESPROMED_BIO. Caracas. Un leve sueño es el único efecto post- vacuna. Estoy en perfectas condiciones. pic.twitter.com/ekmRiWYWdG
— Manuel Zelaya R. (@manuelzr) October 19, 2020
Para la fecha (octubre 2020), «la información aún no aparece en la página del Ministerio [de Salud] ni en las páginas de la autoridad reguladora, que es la que normalmente autoriza los protocolos de investigación clínica; no hay información sobre cómo será el programa de vacunación» dijo a Bioworld, Ariadne Dhersy, profesional de asuntos regulatorios con años de experiencia en ensayos clínicos en Venezuela. «La verdad es que no sabemos dónde están llevando a cabo los protocolos médicos. No creo que haya ninguno» señaló.
Año 2021: información de seguimiento
Las notas preliminares que describen los detalles generales del ensayo clínico fase III fueron traducidas y publicadas el 13 de febrero del año pasado en el portal de la Academia Nacional de Medicina tomando como fuente oficial de información, la página de la base de datos que lo registra mundialmente (ClinicalTrials.gov), y en la que se destacan los objetivos de la investigación desde su inscripción. Se señala además como fecha estimada de culminación para la fase inicial de la prueba: octubre de 2021 (o fecha final de recogida de datos para la medida de resultado primaria).
Esta medida inicial o primer resultado del estudio no es más que la tasa de seroconversión y se refiere al aumento de al menos cuatro veces el título de anticuerpos (Acs) en el suero de los 2000 sujetos participantes frente al antígeno o blanco experimental (en este caso, la glicoproteína del SARS-CoV-2) comparado con la medida de Acs del día de inicio de la prueba (antes de inyectar la vacuna o el placebo), y permite verificar la protección obtenida mediante la vacuna. Entonces, si tras la administración de esta, se logra una seroconversión del 99%, significa que el 99% de las personas vacunadas han adquirido inmunidad frente al agente infeccioso y por tanto están protegidas contra la enfermedad. Para demostrarla, es necesario analizar al menos dos sueros de la misma persona separados por un intervalo de tiempo variable, por ejemplo dos semanas, para el caso del ensayo que nos ocupa, se estableció un tiempo de 42±2 y 180±14 días después de la primera dosis. Por otra parte, como medidas específicas del ensayo se establecieron en la vista tabular de la base de datos, las siguientes mediciones:
- La incidencia y gravedad de los acontecimientos adversos a lo largo del estudio (hasta el día 180)
- Los niveles de anticuerpos neutralizantes del virus (contra el SARS-CoV-2) medidos a 42 días de la inoculación
- Los niveles de anticuerpos contra la glicoproteína del SARS-CoV-2 medidos a 42 días y 180 días
- El Porcentaje de sujetos del ensayo con enfermedad por COVID-19 durante todo el estudio (hasta el día 180) confirmado con el método de reacción en cadena de la polimerasa (PCR)
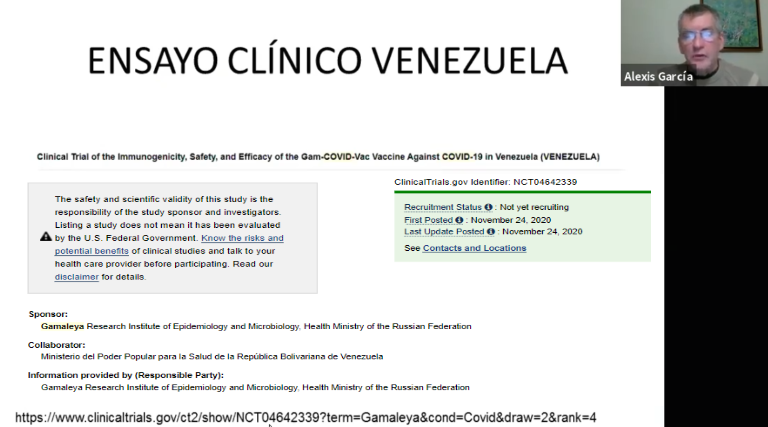
El Dr. Alexis García Piñero, médico inmunólogo, investigador principal y director del ensayo, muestra una diapositiva con los detalles generales del estudio inscrito en ClinicalTrials.gov, durante un seminario web organizado por la Sociedad Venezolana de Infectología el 17 de febrero de 2021.
En distintas plataformas comunicacionales donde se organizaron conferencias, seminarios de divulgación para sociedades científicas, grupos universitarios y académicos, el Dr. García Piñero enfatizó que «la mejor vacuna es la que te toca» e intentó explicar grosso modo algunos tecnicismos sobre las plataformas vacunales. Pero, reiteradamente, esquivó preguntas sobre el protocolo del ensayo clínico, insinuando no estar al tanto en cómo se llevaron a cabo detalles claves como el reclutamiento de participantes porque, según afirmó, la selección la realizó la plataforma gubernamental Patria.
Por otra parte, algunos voluntarios que participaron del estudio, como la Dra. Rommie Merino-Alado, adjunta de la sección de Micología Médica Dr. Dante Borelli IMT-UCV, escribió en la red social Instagram:
«La convocatoria en este caso para la fase III fue pequeña ya que inicialmente contaría con un total de 500 muestras (vacunas y placebos). Entonces la convocatoria no fue pública sino un poco boca-a-boca. A su vez, los que participamos hicimos vocería»
Durante varias sesiones de preguntas, García Piñero no ofreció detalles de las secuencias genéticas analizadas en las pruebas moleculares (PCR) más allá de referir al protocolo de Berlín, que amplifica dos regiones virales y que ya habían sido explicados por la Dra. Flor Pujol del Instituto Venezolano de Investigaciones Científicas (IVIC). Tampoco de los estudios serológicos del ensayo, que miden niveles de anticuerpos en los participantes, donde rescató generalidades:
«No se hizo prueba rápida sino un ELISA» al tiempo que insistió «seguimos al pie de la letra el protocolo ruso publicado en The Lancet, pero a diferencia de Gamaleya hicimos radiografía de tórax a todos los participantes del estudio»
Algunas respuestas a preguntas lícitas
Varias cuestiones sobre el diseño de investigación quedan por contestar y fueron inicialmente formuladas por el experto en revisiones sistemáticas y metaanálisis de la colaboración Cochrane, el Dr. Arturo Martí-Carvajal, como siguen:
1. No fue posible analizar varios aspectos claves de un ensayo clínico típico, por ejemplo:
-
- ¿Cuáles fueron las determinantes para calcular el tamaño de la muestra?
El número de sujetos participantes es clave, porque estadísticamente este número puede reducir el error, por ejemplo, entre más pequeña sea la muestra del estudio, la capacidad del ensayo para detectar diferencias entre las hipótesis (a probar: seguridad y eficacia de la vacuna) es baja hay una probabilidad mayor de cometer error o que no se proporcionen resultados estadísticamente significativos.
-
- ¿Cómo se haría la aleatorización del estudio y su enmascaramiento?
En otras palabras ¿a quiénes se les administra la vacuna experimental y quiénes recibirán el placebo? ¿Cómo se garantiza que ni el investigador ni el participante sepan que están administrando o recibiendo? (Estudio aleatorizado y doble ciego).
2. Como se mencionó antes, el registro del portal ClinicalTrials.gov revela que hasta la fecha no se están reclutando participantes.
3. Se desconocen los centros donde se está llevando a cabo el ensayo y/o dónde se realizan las pruebas de laboratorio para conocer los niveles de anticuerpos.
A la primera cuestión recurrente, García Piñero respondió en una transmisión en vivo para la Sociedad Venezolana de Alergia, Asma e Inmunología* (@svaai) el 18 de marzo de 2021, que ahora no se trataba de un ensayo de 2000 participantes, sino que se redujo el número de la muestra al tiempo que concluyó el reclutamiento por anunciarse el uso de emergencia del producto:
«…de unos 320 candidatos presentados fueron seleccionados 196 participantes que cumplían criterios de inclusión y exclusión, recibiendo ambas dosis, por lo que, finalmente, el ensayo clínico de fase III pasó más bien a ser un ensayo de fase II B… Vamos a tener datos de eficacia que aunque no son tan importantes, van a ser parte de la mega data de lo que se está haciendo con esta vacuna a nivel mundial»
Aunque no ofreció detalles sobre el protocolo completo, García Piñero dijo que los cambios en los objetivos —no oficiales— de la investigación, se deben a que no fue posible aplicar la tecnología rusa para medir respuesta en términos de inmunogenicidad y eficacia dentro del territorio nacional, resaltando:
«Tuvimos que enviar las muestras a Rusia y [el instituto] Gamaleya se encargará de procesarlas y analizar los datos…Hablé con Flor Pujol, y me explicó que necesitábamos mucho personal para procesar las muestras, se necesita además una línea celular para medir el efecto citopático de neutralización del virus por lo que nos resultó más fácil agrupar, identificar y enviar las muestras a Rusia. Sin embargo, vamos a tener nuestro estudio local de un grupo de estos pacientes vacunados para que Flor pruebe la neutralización en los sueros contra ciertos péptidos y mida respuesta…»
Sobre el segundo punto, el investigador señaló que es un error de actualización en la base de datos que registra todos los ensayos clínicos a nivel mundial. Por último, y a fin de medir seguridad de la respuesta inmune durante el ensayo, aseguró que el hospital donde se llevó a cabo el estudio, el cardiológico infantil Dr. Gilberto Rodríguez Ochoa de Caracas, contaba con todo lo necesario y estaba aprobado por un comité de ética, que hasta la fecha continúa anónimo.
A la poca transparencia de la participación de Venezuela en estudios clínicos, se suma el anuncio de Nicolás Maduro en marzo de 2021 sobre el inicio del ensayo clínico para los candidatos vacunales cubanos Abdala y Soberana II, próximo a llevarse a cabo sin que concluya oficialmente la primera experiencia con Sputnik V.
Por otra parte, el debate ético de realizar estos estudios cuando ya se administran vacunas de emergencia y/o aprobadas «es que tendríamos que garantizar dosis para el grupo placebo en plena pandemia» refirió el mismo García Piñero en una entrevista radial anterior, con la periodista Shirley Varnagy transmitida por el circuito onda el día 8 de febrero de 2021.
Sobre la vorágine de estos acontecimientos, la Academia de Medicina y la Academia de Ciencias Físicas, Matemáticas y Naturales en Venezuela insistió con una crítica contundente:
«La urgencia para contribuir a la evaluación de una vacuna que pueda ayudar al control de la pandemia en nuestro país no debe vulnerar los principios científicos y éticos internacionalmente aceptados y debe hacerse con la mayor transparencia y con el apoyo de la población venezolana y de su comunidad médica y científica»
Finalmente, el 22 de septiembre de 2021 el investigador principal del ensayo, Dr. García Piñero en una nueva entrevista con Varnagy, declaró que la fecha oficial del inicio del estudio fue el 3 de diciembre de 2020, al tiempo que estableció julio del 2021 como periodo de cierre. Sin embargo, el ensayo fase III registrado para Sputnik V en Venezuela sigue sin actualizaciones desde su registro (24/11/2020) y en el estado de reclutamiento de participantes, figura que todavía no se está reclutando.
A pesar de lo expuesto, actualmente, al menos el primer componente de la vacuna de Gamaleya ha sido administrado masivamente. Gracias a los datos recogidos por el estudio intermedio de fase III sobre Seguridad y Eficacia llevado por la federación rusa en unos 21977 participantes, y cuyos resultados fueron publicados con celeridad en la revista científica The Lancet, donde se concluye respecto a los objetivos (descritos en la misma base de datos donde se inscribió el ensayo de Venezuela) que Sputnik V expone:
- Seguridad y eficacia del 91,6 % contra COVID-19 sintomático con aplicación de dos dosis de la vacuna.
- Ausencia de efectos adversos severos. Misma eficacia y buena tolerancia en adultos mayores de 60 años.
Con la emisión de frecuentes boletines y pronunciamientos desde inicios de la pandemia de COVID-19, las Academias de la Medicina y de las Ciencias han mostrado una genuina preocupación y ofrecen (constitutivamente) asesoramiento al estado venezolano en la urgente materia de salud pública que aqueja al país.
Para este momento el 62,5 % de la población mundial ha recibido al menos una dosis de la vacuna COVID-19. Se han administrado más de diez mil millones de dosis en todo el mundo y 33.550.000 de dosis se administran cada día. Sólo el 12 % de las personas en los países de bajos ingresos han recibido al menos una dosis. Este esfuerzo debe aumentar si se pretende controlar la pandemia. Además de los indudables beneficios individuales y colectivos de la vacunación, también puede ser una forma de disminuir la replicación viral a nivel global, disminuyendo la posibilidad de la emergencia mutacional o la aparición de nuevas variantes.
El 19 de mayo de 2021 la Organización Panamericana de la Salud (OPS) pidió a Nicolás Maduro que suministre «información transparente y a tiempo» sobre el avance de la vacunación en Venezuela contra el coronavirus. Ciro Ugarte, director del Departamento de Preparación para Emergencias y Desastres de la OPS, indicó:
«No tenemos información actualizada sobre el avance de la vacunación en Venezuela. Hasta la última información que teníamos disponible, se habían aplicado más de 316 mil dosis a los grupos prioritarios, entre ellos el personal de salud del 79% de las vacunas que habían llegado al país»
A pesar de las cifras reportadas por Our World in Data para el 18 de febrero de 2022, y pese de los recientes anuncios gubernamentales, se mantiene el clamor de las distintas sociedades médicas venezolanas por el aumento en la cobertura de vacunas aprobadas y preocupación por el uso de candidatos vacunales cubanos en la población venezolana (Abdala y Soberana 02).
El ensayo clínico de la vacuna Sputnik V en Venezuela deja muchas interrogantes
¿Se realizó una verdadera convocatoria pública, en la que partiendo del principio de justicia, tuviese acceso toda la población venezolana por igual? ¿Fue transparente la selección de participantes? Una vez que se determinó qué voluntarios cumplían con criterios de inclusión/exclusión (antes de anunciarse como tal) ¿Es posible que algunos de ellos estuviesen enterados de recibir una dosis experimental (vacuna) y no el placebo, tal como lo declaran?
¿Se justifican los cambios en el diseño de una investigación clínica en tiempo real sin reportarlo en la base de datos de ensayos clínicos a nivel mundial? ¿Cómo afectan estos cambios al protocolo y su(s) objetivo(s) inicial(es)? ¿Hay algún anuncio público y notorio del comité de ética que asesoró y validó este estudio a grandes o pequeños rasgos? ¿Condujo este ensayo a algún resultado en la población venezolana que justifique la investigación y en tal sentido demuestre o refute los datos publicados oportunamente en otros ensayos clínicos fase III llevados a cabo con esta vacuna?
A 6 meses del cierre del ensayo, ¿Existe algún resultado preliminar del estudio local que haya sido publicado -oportunamente- en términos de seguridad, inmunogenicidad o eficacia? ¿Todos los participantes inscritos inicialmente culminaron el protocolo?, ¿Recibieron los voluntarios de ambos grupos -experimental y placebo- el esquema completo de vacunación con Sputnik V, una vez que se completó el ensayo?
Por definición, la seguridad y la validez científica de este estudio son responsabilidad del patrocinador y de los investigadores del mismo. Después de la participación de la autora de este artículo*, en la sesión de preguntas durante la trasmisión de la @svaai, el director del ensayo Dr. Alexis García Piñero (en IG: @idiucv1989) bloqueó su cuenta personal de esta red social y hasta la publicación de este reportaje, sobre el cual fue informado vía correo electrónico, no ha dado respuesta y/o comentarios finales.
Bibliografía
- Berlinger N, Wynia M, Milliken A, Cohn F, Guidry-Grimes LK, Bruce L, Oei G, Lipman HI, Cheatham C. Responding to Covid-19 as a regional public health challenge. Preliminary guidelines for regional collaboration involving hospitals. The Hastings Center. “http://www. thehastingscenter.org”. April 29, 2020.
- CIDH. Las Vacunas contra la COVID-19 en el marco de las obligaciones interamericanas de derechos humanos. Resolución N°1/2021. Comisión Interamericana de Derechos Humanos
- Esparza J. COVID-19: Una pandemia en pleno desarrollo. Gac Med Caracas 2020; 128(1):1-7.
- Feliciano D. Venezuela will begin to apply Cuban vaccine Abdala, without customary trials or regulatory approval. March 2021 https://www.riotimesonline.com/brazil-news/mercosur/venezuela/venezuelan-regime-will-begin-to-apply-in-july-the-cuban-vaccine-abdala-which-has-not-completed-the-trials-and-has-not-been-approved/
- Loyo ESL, González MJ & Esparza J. Venezuela is collapsing without COVID-19 vaccines. Lancet. 2021 May 15;397(10287):1806. doi: 10.1016/S0140-6736(21)00924-7. PMID: 33992140; PMCID: PMC8118609.
- Marcano Arciniegas, D. ¿Qué se sabe de la vacuna Sputnik V que será aprobada en Venezuela? http://factor.prodavinci.com/SputnikEnVenezuela/index.html?home (October 2020).
- Martí-Carvajal, A. (2010) Taking Aim at a Moving Target: When a Study Changes in the Middle. Streiner and Sidani, When Research Goes Off the Rails (1st ed., Chapter 35 pp. pp. 299–302). The Guilford Press.
- Meagher KM, Cummins NW, Bharucha AE, Badley AD, Chlan LL, Wright RS. COVID-19 Ethics and research., Mayo Clin Proc 2020;95(6):1119-1123, doi: https:// doi.org/10.1016/j.mayocp.2020.04.019.
- OWID. February 2022. https://ourworldindata.org/covid-vaccinations?country=VEN
- Page KR, Doocy S, Reyna Ganteaume F, Castro JS, Spiegel P, Beyrer C. Venezuela’s public health crisis: a regional emergency. Lancet. 2019 Mar 23;393(10177):1254-1260. doi: 10.1016/S0140-6736(19)30344-7. Epub 2019 Mar 11. PMID: 30871722.
- Pujol, FH, & Esparza, J. (2021). COVID-19: VIRUS, VARIANTES Y VACUNAS/COVID-19: VIRUS, VARIANTS AND VACCINES. Boletín de la Academia de Ciencias Físicas, Matemáticas y Naturales Vol. LXXXI, n.° 2, Número especial COVID-19, pp.1-10 (2021)
- Requena, J. (2021) ESTADO DE CIENCIA Y TECNOLOGÍA EN VENEZUELA: ACTUALIZACIÓN AL AÑO 2020 SCIENCE & TECHNOLOGY IN VENEZUELA: 2020. Boletín de la Academia de Ciencias Físicas, Matemáticas y Naturales Vol. LXXXII, n.° 1, pp. 7-18 (2022)
- Vizcaíno G, Esparza J. Coronavirus pandemic. Ethical conflicts in COVID-19 times. J Infect Dev Ctries 2020; 14(9):968-970. doi:10.3855/jidc.13137.
- Vizcaíno, G., & Esparza, J. (2021). Perspectiva de los dilemas éticos relacionados con la pandemia COVID-19.: Ethical dilemmas related to the COVID-19 pandemic. A perspective. Investigación Clínica, 61(4), 393-405. https://doi.org/10.22209/IC.v61n4a07
- WHO. April 28, 2020. https://www.who.int/news-room/detail/24-04-2020-global-leaders-unite-toensure-everyone-everywhere-can-accessnew-vaccines-tests-and-treatments-for-covid-19.
Pronunciamientos de las Academias Venezolanas:
- Ensayos Clínicos Fase III de Sputnik V
- Candidato vacunal Abdala
- Candidato vacunal Abdala y Soberana 02
-Otros pronunciamientos de la Academia de Ciencias Físicas, Matemáticas y Naturales de Venezuela respecto a la pandemia COVID-2019.
Maricef Vergara-Rubio ([email protected]) es biólogo en el Departamento de Biología de la Universidad de Los Andes (ULA) Mérida-Venezuela, egresada de la misma universidad. Ganó en 2017 una beca de posgrado de la Agencia Nacional de Promoción Científica y Tecnológica de la Argentina. Es miembro adherente de la Sociedad Argentina de Inmunología (SAI) desde el 2018 y le otorgaron la beca de finalización del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) para la convocatoria del año 2020. Es becaria doctoral del laboratorio de Inmunología Experimental del Instituto de Medicina Experimental (IMEX-CONICET) de la Academia Nacional de Medicina (ANM) y cursa el penúltimo año de doctorado de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires (FFyB-UBA). Sus inicios en la divulgación científica comenzaron como colaboradora editorial en la revista GuíaEMédica en Venezuela, y en el año 2020, trabajó como voluntaria para diagnóstico COVID-19 en el Instituto de Investigaciones Biomédicas en Retrovirus y SIDA (INBIRS), al tiempo que lideró el proyecto COVID19VE, en apoyo a sociedades organizaciones científicas venezolanas y en homenaje a su alma mater, desde siempre faro de luz para Venezuela. Sus redes sociales: Twitter @maricefv e Instagram @maricef.
Crédito de la ilustración de Portada: Ada Peña.
EXENCIÓN DE RESPONSABILIDAD: Fundación Persea no se hace responsable del contenido de este artículo.




Wow! No había visto los comentarios. Gracias por el feedback, sobre todo a la periodista (campo nuevo para mi). Me entusiasma mucho poder plasmar con sus bemoles, mi primer artículo en un tema que vengo siguiendo desde la academia y que me toca además, como investigadora venezolana. Quedan muchas cosas por mejorar -pero de nuevo- gracias a todos por sus palabras!
Excelente artículo. Fácil de entender para quiénes somos ajenos al mundo de la investigación científica, y bastante revelador. Increíble los descontroles y falta de ética que abundan en el ámbito de salud venezolano. Gracias a la autora por su ardua investigación y compromiso.
Como mujer de ciencia aprecio y aplaudo el trabajo minucioso, detallado y tan claramente comunicado (tristemente, esto último es algo que no siempre logramos), que la autora ha realizado durante los dos últimos años, haciendo un seguimiento tan amplio a todas las fuentes y actores involucrados en el tema. Pero más que nada, como venezolana, agradezco la ardua labor y el compromiso de la autora para dejar en evidencia cómo el gobierno de Nicolas Maduro y sus representantes en temas de salud sólo se han preocupado por realizar anuncios vacíos con fines mediáticos, sin respetar realmente los principios mínimos de ética en un escenario tan delicado como el de los últimos años en medio de la pandemia, cuando en realidad su responsabilidad sería garantizar la igualdad de acceso y la calidad de la salud para todos los venezolanos, algo que evidentemente no ocurre en Venezuela, desde hace muchos años. Sospecho y temo que, como en tantos otros escenarios que impactan la calidad de vida de los venezolanos, nunca tendremos respuestas a esas preguntas justas que nos plantea.
Excelente artículo, buena explicación concisa de las fases de desarrollo de una vacuna y que bien que se expone la falta de claridad del ensayo venezolano. Ojalá que algún día obtengamos respuestas a las interrogantes
Muy buen artículo. La estructuración del mismo me parece acertada ya que permite tener presente de manera clara y sencilla los puntos clave para lectores no versados en el ámbito científico, asimismo, es posible entender el método aplicado en la investigación. Un tema interesante y preocupante que guarda coherencia con las prácticas en materia de salud en Venezuela.